单细胞测序揭示重塑胃黏膜细胞组成与细胞间通讯鑫耀证券。
胃癌是全球第五大常见恶性和第三大癌症相关死亡原因,尤其在东亚地区高发[ 1]。多数患者确诊时已属晚期,预后较差。幽门螺杆菌(H.pylori)感染被世界卫生组织列为I类致癌物,是胃癌发生的主要风险因素[ 2]。胃癌多遵循Correa级联反应发展,即从慢性非萎缩性胃炎(GS)、肠上皮化生(IM)逐步进展为肠型胃癌(GC)[ 3]。尽管根除H.pylori可降低胃癌风险,但其在癌前病变阶段的作用机制尚不明确。
胃癌是一个由上皮细胞、基质细胞和免疫细胞共同构成的复杂生态系统。单细胞RNA测序(scRNA-seq)技术为解析这一系统提供了有力工具[ 4]。既往研究虽已初步揭示胃癌微环境中部分细胞类型的转录特征,但对H.pylori感染背景下各细胞亚型在癌变过程中的动态变化及细胞间通讯网络仍缺乏系统性认知。
近期一项研究通过对18例不同病理阶段(GS、IM、GC)的胃黏膜组织进行scRNA-seq分析,共获得91,394个高质量单细胞转录组数据,系统揭示了H.pylori感染引起的细胞组成改变、转录异质性及细胞间相互作用,为深入理解H.pylori驱动的发生机制提供了全新视角。

图1 研究标题
研究方法
患者与样本
研究纳入18例患者,包括6例GS、6例IM和6例GC,每组按H.pylori感染状态进一步分组。所有样本经病理确认,H.pylori感染状态通过¹³C-尿素呼气试验、免疫组化(IHC)和免疫荧光(IF)验证。
单细胞RNA测序与数据分析
组织经酶消化制备单细胞悬液,采用10×Genomics Chromium平台进行scRNA-seq。经质控过滤后,使用Seurat R包进行细胞聚类与注释,共识别9大细胞类型:上皮细胞、内皮细胞(EC)、成纤维细胞、平滑肌细胞、T细胞、B细胞、髓系细胞、浆细胞和肥大细胞。
功能与机制分析
拷贝数变异(CNV)分析:使用InferCNV评估上皮细胞恶性程度。
轨迹分析:采用Monocle2/3推断细胞分化路径。
转录调控网络:通过SCENIC分析识别关键转录因子及其调控子(regulon)。
细胞间通讯分析:利用CellChat推断配体-受体互作网络。
实验验证:包括IHC、IF、qRT-PCR,并在INS-GAS转基因小鼠模型中验证H.pylori感染对肠化生的诱导作用。
公共数据验证
结合TCGA-STAD及GEO(GSE122401、GSE65801、GSE13195)数据库中的批量RNA-seq数据,验证关键基因表达模式。
研究结果
细胞组成动态变化揭示胃癌演进特征
scRNA-seq分析显示,随着病变进展(GS→IM→GC),上皮细胞比例逐渐下降,而髓系细胞和内皮细胞比例显著上升(图2D)。H.pylori阳性样本中上皮细胞比例进一步降低,内皮与髓系细胞比例升高(图2E)。IHC验证显示,GC组织中CD31(EC标记)与CD68(髓系标记)表达上调,而上皮标记TFF1表达下降(图2G–H)。
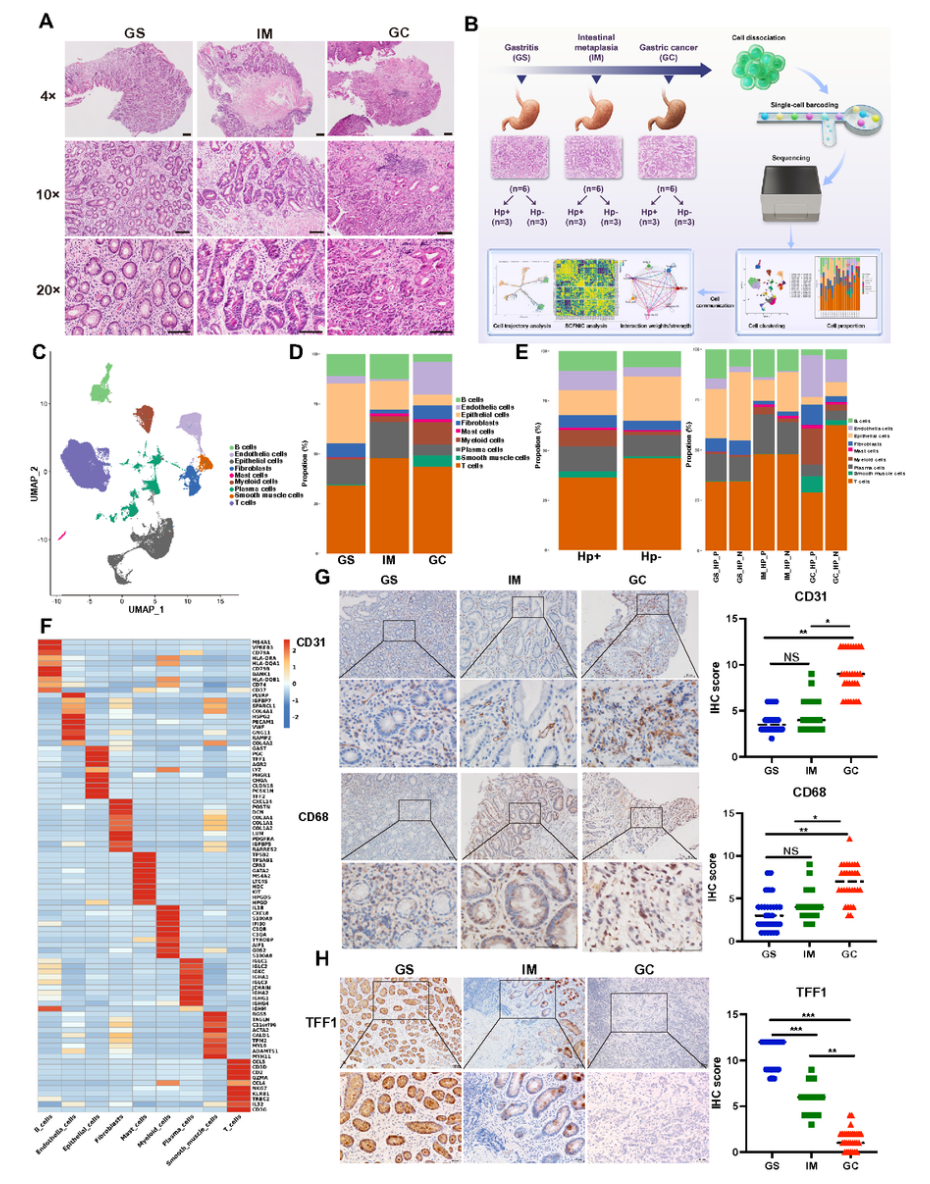
图2 细胞组成与比例变化
上皮细胞亚群揭示癌变关键节点
上皮细胞被进一步分为19个亚群,包括pit黏液细胞、颈黏液细胞、主细胞、壁细胞、内分泌细胞、肠内分泌细胞、肠上皮细胞和肿瘤样上皮细胞(tumor-like EPC)。肠上皮细胞(表达FABP1、KRT20)在IM组织中高度富集(图3C),而肿瘤样EPC(表达CEACAM5、KRT17)在GC组织中显著增多(图3E–F)。CNV分析显示肿瘤样EPC具有更高的基因组不稳定性(图3D)。轨迹分析表明其起源于pit黏液细胞(图3H)。GSEA提示肿瘤样EPC富集于Notch、PI3K/AKT、Wnt等促癌通路(图3I)。
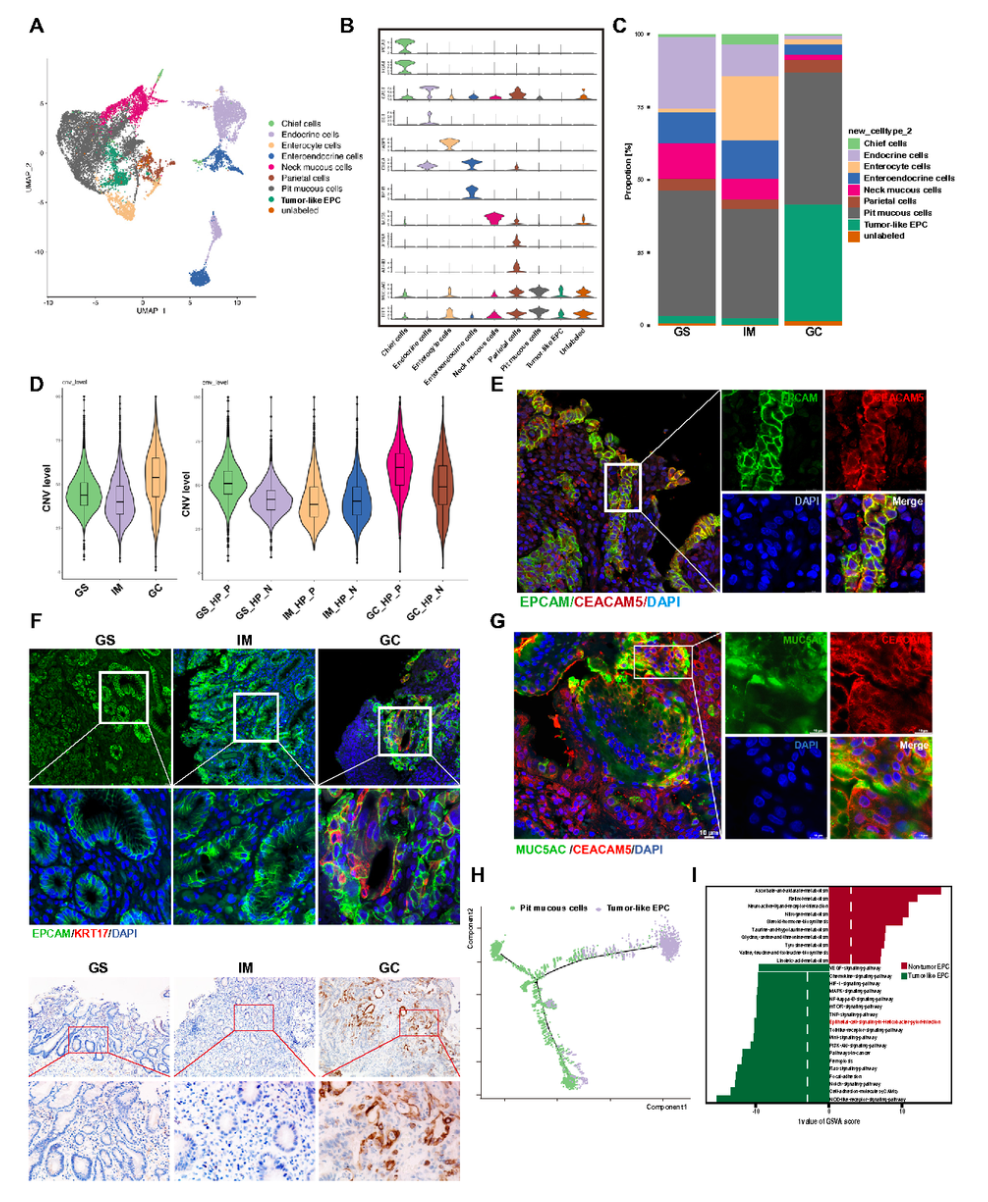
图3 上皮细胞亚群与肿瘤样EPC特征
肠上皮细胞特征与HNF4G调控作用
肠上皮细胞在IM阶段特异性高表达脂代谢相关基因(FABP1、APOC3)和肠道标志物(KRT20、ANPEP)(图4A–C)。SCENIC分析识别HNF4G为其关键转录因子,其与下游83个靶基因(如FABP1、APOB)共同构成调控网络(图4D–E)。IHC证实HNF4G在IM组织中高表达(图4F–G)。
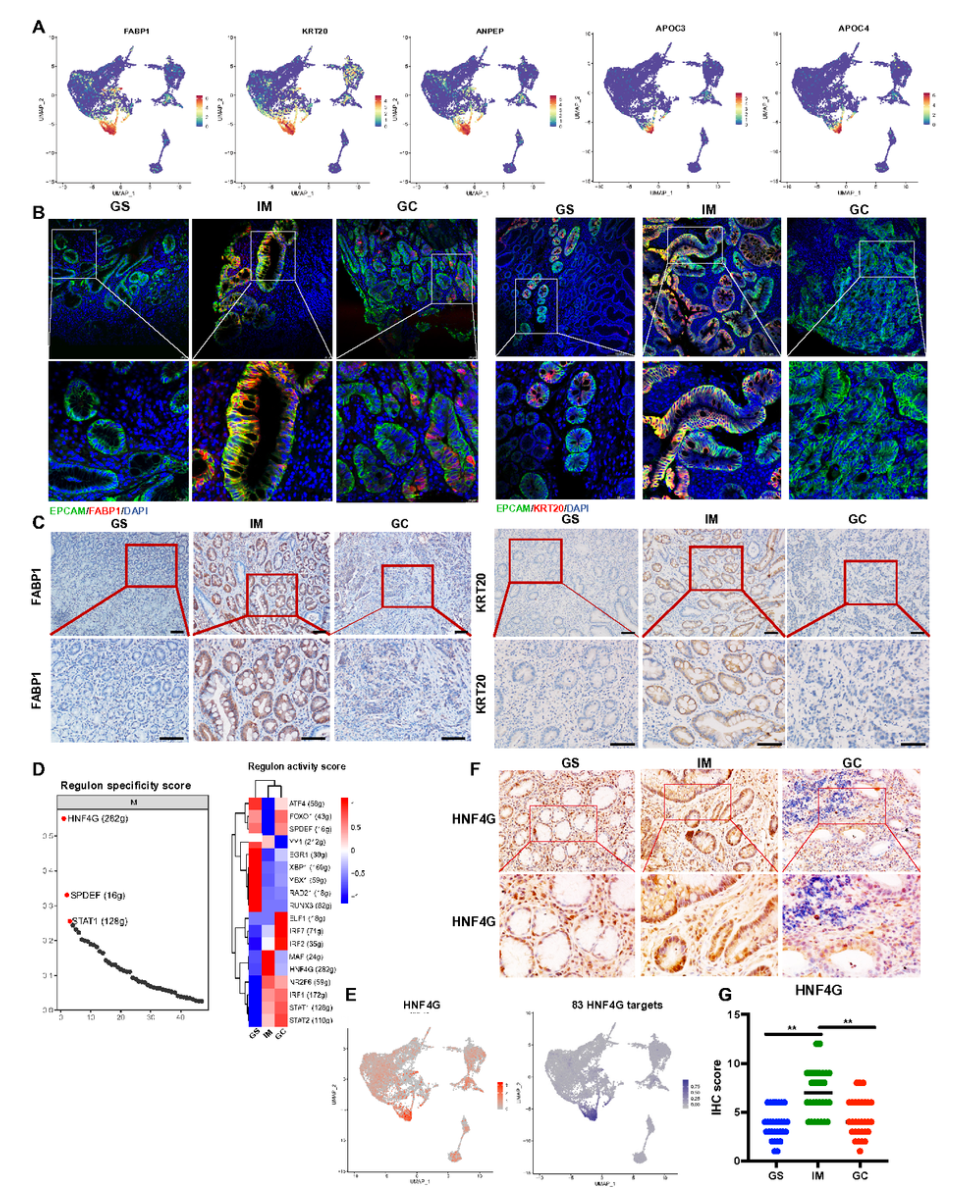
图4 肠上皮细胞与HNF4G调控网络
H.pylori感染诱导上皮细胞基因表达改变鑫耀证券
H.pylori阳性上皮细胞中,胃酸分泌相关基因(PGC、LIPF、GAST)表达下调,而肠化生标志物(FABP1、KRT20、OLFM4)表达上调(图5C–E)。qRT-PCR验证ANPEP、FABP1等在H.pylori阳性IM组织中表达升高(图5F–I)。INS-GAS小鼠模型中,H.pylori感染诱导胃黏膜出现IM病变,并伴随FABP1、KRT20和HNF4G表达上调(图6)。
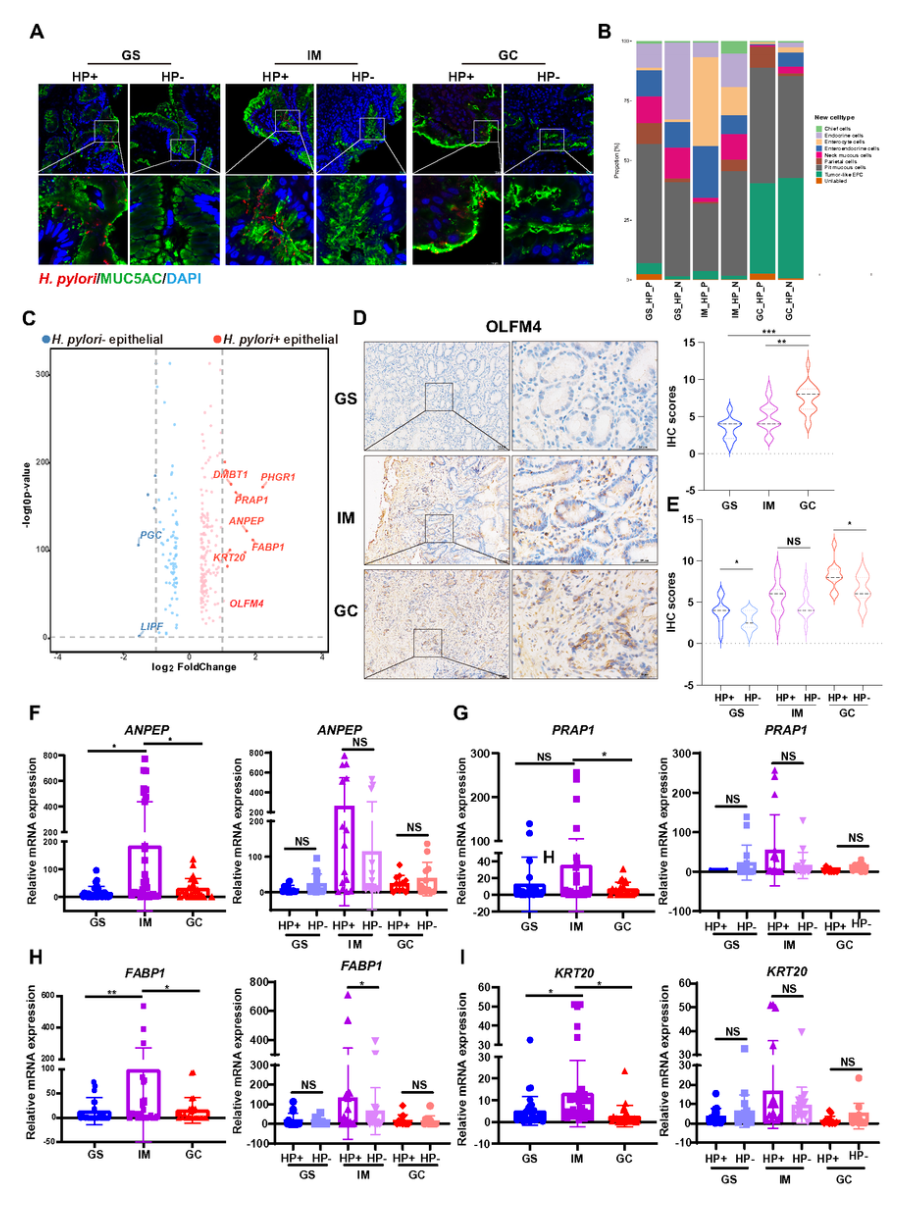
图5 基于幽门螺杆菌感染状态的上皮细胞转录组异质性
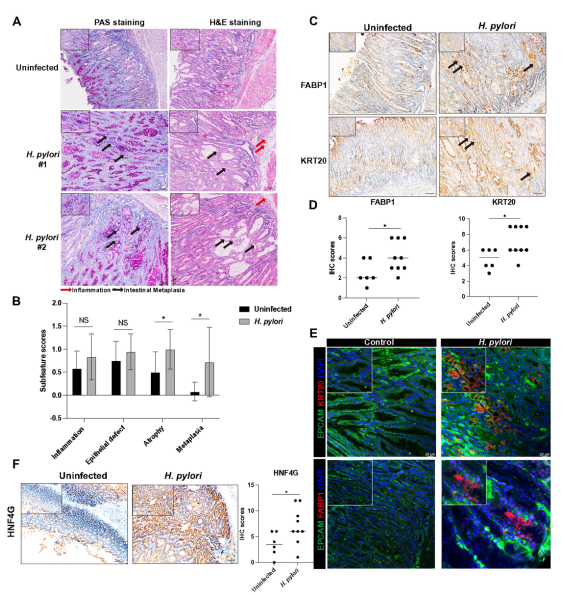
图6 幽门螺杆菌感染在INS-GAS小鼠中诱导肠上皮化生并启动肠上皮细胞特征
内皮细胞与成纤维细胞在肿瘤微环境中的作用
内皮细胞被分为7个亚群,其中肿瘤样EC(表达LGALS1、COL4A1)在GC组织中显著富集,且与PI3K/AKT信号通路和细胞黏附功能相关(图7A–G)。CellChat分析预测EC通过COL4A1-CD44/SDC4和VEGFA-FLT1/KDR信号轴与肿瘤样EPC相互作用(图7H–J)。
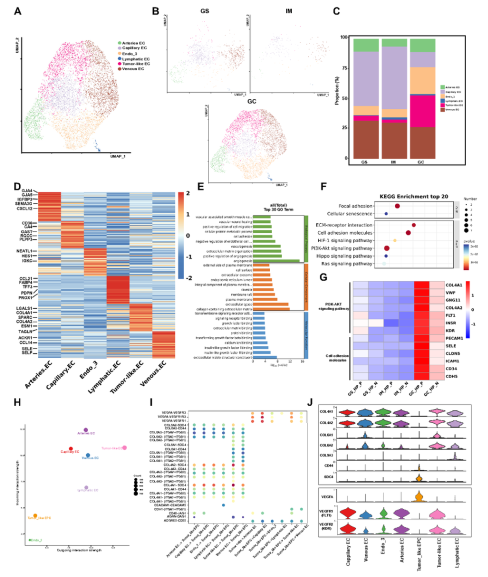
图7 内皮细胞的异质性及其与上皮肿瘤细胞亚型的互作网络预测
成纤维细胞在GC中呈现癌相关成纤维细胞(CAFs)表型,包括抗原呈递CAFs(apCAFs)、上皮-间质转化CAFs(EMT_CAFs)和炎症CAFs(iCAFs)。iCAFs高表达C3、CXCL1等免疫调节因子,在GC组织中比例显著升高(图8E–F)。轨迹分析提示iCAFs起源于ECM成纤维细胞(图8G)。H.pylori阳性样本中CAFs比例升高,FN1和CXCL8表达上调(图8J–M)。
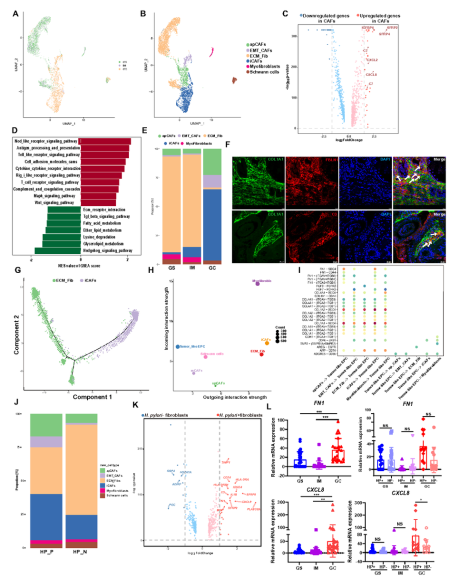
图8 幽门螺杆菌相关胃癌前与癌变样本中成纤维细胞亚群的特征分析
髓系细胞与T细胞亚群参与免疫调控
髓系细胞包括巨噬细胞、单核细胞、cDC1、cDC2、mDC和肿瘤相关巨噬细胞(TAM)。TAM和单核细胞在GC组织中显著富集,且具有M2型免疫抑制表型。H.pylori阳性髓系细胞中CXCL3、TIMP1、CD14和CTSL表达升高。
T细胞分析识别出14个亚群,包括CD4+Treg细胞和CD8+细胞毒性T细胞。Treg细胞在GC组织中比例升高,CD8_IL17A亚群在H.pylori阳性GS组织中增多。多色IF验证CD8+MKI67+T细胞在GC组织中存在。
细胞通讯网络揭示H.pylori驱动机制
CellChat分析显示,H.pylori阳性样本中细胞间通讯更活跃,SPP1、TNF、THY1和补体通路信号增强(图9F–G)。TNF-TNFRSF1A(TNFR1)信号在H.pylori阳性样本中显著激活(图9H–I)。iCAFs作为主要信号发送者,通过COL1A1、MIF、C3和APP信号与髓系细胞(尤其是TAM)密切互作(图9D–E)。
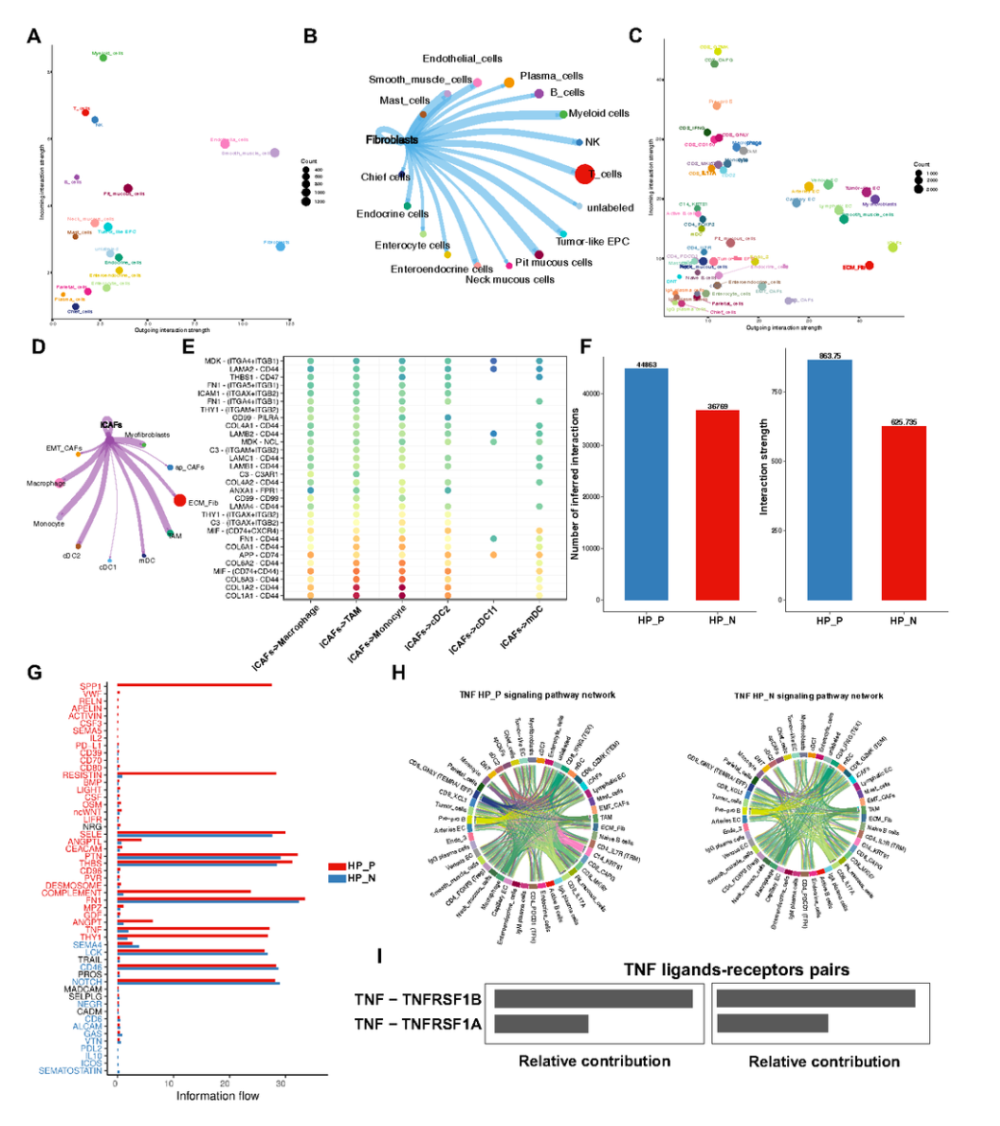
图9 多细胞通讯网络塑造幽门螺杆菌驱动的胃癌发生微环境
总结
本研究通过大规模单细胞转录组分析,系统揭示了H.pylori感染在胃癌发生过程中对细胞组成、转录程序和细胞间通讯的深远影响。主要创新点包括:
识别了肠上皮细胞和肿瘤样EPC两个关键上皮亚群,分别主导IM和GC阶段;
揭示了HNF4G作为肠上皮细胞的关键转录调控因子;
明确了iCAFs和肿瘤样EC在塑造免疫抑制微环境中的作用;
构建了H.pylori 感染背景下多细胞通讯网络,发现TNF、SPP1等信号通路异常活跃。
研究局限性包括样本量有限、未涵盖所有胃癌分子亚型,以及AI模型的“黑箱”问题。未来需通过功能性实验验证关键基因与通路机制。但总体而言,本研究的发现为理解H.pylori相关胃癌的发病机制提供了全新视角,并为开发早期诊断标志物和靶向治疗策略奠定了坚实基础。
参考文献:
[1] Arnold M et al. Global burden of oesophageal and gastric cancer by histology and subsite in 2018. Gut. 2020.
[2] Crowe SE. Helicobacter pylori Infection. N Engl J Med. 2019.
[3] Correa P & Piazuolo MB. Helicobacter pylori Infection and Gastric Adenocarcinoma. US Gastroenterol Hepatol Rev. 2011.
[4] Zhang M et al. Dissecting transcriptional heterogeneity in primary gastric adenocarcinoma by single cell RNA sequencing. Gut. 2020.
审批编号: CN-170462 过期日期: 2026-10-27本材料由阿斯利康提供,仅供医疗卫生专业人士参考
*“医学界”力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
信康配资提示:文章来自网络,不代表本站观点。